La teoría del estado de transición ha jugado un papel fundamental desde sus orígenes en la Cinética Química. Hoy en día, la interpretación más geométrica de esta teoría, basada en avanzadas herramientas matemáticas de los sistemas dinámicos, ha permitido comprender mejor los mecanismos subyacentes que regulan una reacción química, así como extender sus aplicaciones más allá de la Química a la Mecánica Celeste, la Física de la Materia Condensada o la Física Atómica, entre otros campos.
Objetivos
- Desarrollar nuevos métodos para la identificación de trayectorias reactivas en sistemas sometidos a un pulso láser.
- Identificacar el mecanismo de reacción en sistemas sometidos a acciones externas (pulsos láser, baños, fuerzas mecánicas…).
- Desarrollar nuevos métodos de control de la reactividad basados en el cálculo de estructuras invariantes (NHIM, variedades invariantes, etc.).
Descripción
Una de las preguntas fundamentales a las que trata de responder la Química es si una reacción se va a llevar a cabo y, en caso afirmativo, con qué velocidad. El problema que tenemos para responderla es que, en general, ningún átomo ni molécula reacciona aislado sino en presencia de un entorno, lo que hace que resulte imposible abordar el estudio del problema anterior de forma exacta por el elevadísimo número de partículas que tiene, del orden del Número de Avogadro: 10 seguido de 22 ceros, ¡¡¡imposible de contar!!!! Por eso, los químicos y físicos métodos aproximados que nos permitan dar respuesta a esta pregunta tan importante.
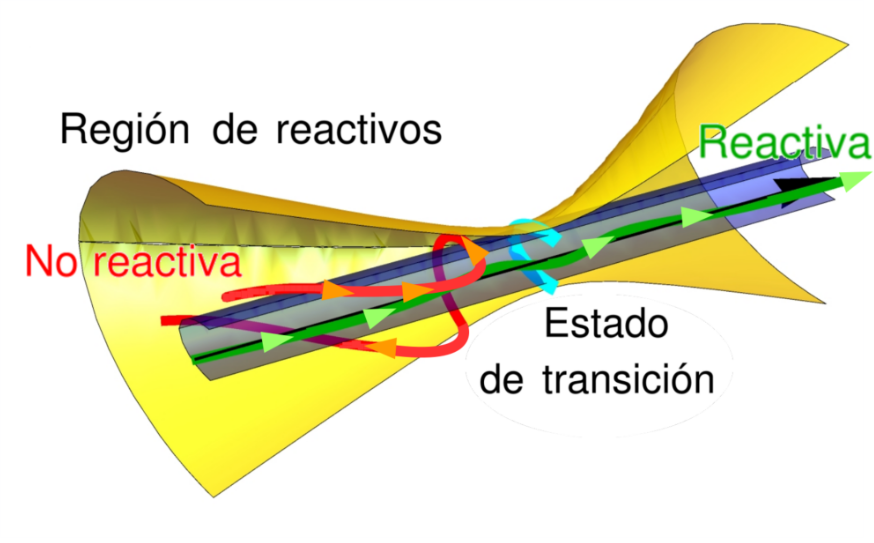
Uno de estos métodos es la llamada teoría del estado de transición [1, 2], comúnmente conocida por sus siglas en inglés TST (“Transition State Theory”). Esta teoría se basa en la existencia de una superficie que divide el sistema en dos partes, reactivos y productos, separados por una barrera de energía. La TST asume que cuando una trayectoria corta esa superficie divisoria, la trayectoria nunca la vuelve a cruzar y el sistema reacciona. Por el contrario, si una trayectoria no corta la superficie divisoria, la TST asume que nunca la cruzará y por tanto el sistema no reacciona [3].
Dentro del Grupo de Sistemas Complejos estamos tratando de extender al campo de aplicación de la TST a otras situaciones que hasta ahora nunca se habían estudiado. Así, hemos sido capaces de observar por primera vez en un sistema molecular realista, el cianuro de litio en presencia de un baño de átomos de argón, el aumento y posterior disminución de la velocidad de reacción al aumentar la interacción con el entorno, efecto denominado Kramer’s turnover [4, 5].
Los últimos años han sido testigos de un extraordinario desarrollo de la industria del láser, lo que ha permitido obtener un control antes inimaginable de las reacciones químicas. Por ello, otras de los aspectos que estamos estudiando en el grupo es qué sucede cuando aplicamos un láser a una molécula con el objetivo de proponer nuevos modelos que permitan mejorar los procesos de producción de la industria química al mejorar la efectividad de los mismos [6, 7].
Volviendo a la idea central de la TST, estamos desarrollando nuevos métodos para identificar “buenas” superficies divisorias, de forma que ninguna de los millones de trayectorias reactivas que tenemos las recrucen [8]. En este sentido, hemos extendido con éxito la TST dependiente del tiempo desarrollada por Bartsch y colaboradores [9] a sistemas anarmónicos [10, 11]. Esto nos ha permitido obtener correcciones a la célebre fórmula de Kramers [12] y, ¡por primera vez de forma analítica!, a la fórmula de Grote-Hynes [13, 14]
Referencias
[1] P. Hänggi, P. Talkner y M. Borkovec, Reaction-rate theory: Fifty
years after Kramers, Rev. Mod. Phys. 62, 251 (1990).
[2] R. A. Marcus, Skiing the Reaction Slopes, Science 256, 1523
(1992).
[3] F. Revuelta, R. M: Benito y F. Borondo, An. Quím. 114 (3), 159 (2018).
[4] P. L. García-Müller, F. Borondo, Rigoberto Hernandez, y R. M. Benito, Phys. Rev. Lett. 101, 178302 (2008).
[5] P. L. García-Müller, Rigoberto Hernandez, R. M. Benito y F. Borondo, J. Chem. Phys. 137, 204301 (2012)
[6] F. Revuelta, Galen T. Craven, Thomas Bartsch, F. Borondo, R. M. Benito y Rigoberto Hernandez, J. Chem. Phys. 147, 074104 (2017).
[7] A. Junginger, Galen T. Craven, Thomas Bartsch, F. Revuelta, F. Borondo, R. M. Benito y Rigoberto Hernandez, Phys. Chem. Chem. Phys. (PCCP) 18, 30270 (2016).
[8] T. Uzer, C. Jaffé, J. Palacián, P. Yanguas y S. Wiggins, The geo-
metry of reaction dynamics, Nonlinearity 15, 957 (2002).
[9] Thomas Bartsch, Rigoberto Hernandez y Turgay Uzer, Phys. Rev. Lett. 95, 058301 (2005).
[10] F. Revuelta, Galen T. Craven, Thomas Bartsch, R. M. Benito y F. Borondo, J. Chem. Phys. 136, 091102 (2012).
[11] F. Revuelta, Galen T. Craven, Thomas Bartsch, R. M. Benito y F. Borondo, J. Chem. Phys. 136, 224510 (2012)
[12] H. A. Kramers, Physica (Utrecht) 7, 284 (1940).
[13] R. F. Grote and J. T. Hynes, J. Chem. Phys. 73, 2715 (1980).
[14] Thomas Bartsch, F. Revuelta, R. M. Benito y F. Borondo, arXiv:1608.05397 (2016).
